Актуальность разработки противоопухолевых препаратов на основе палладия
Онкологическая патология, по данным Всемирной Организации здравоохранения, сегодня занимает второе место в структуре заболеваемости - 23,5% от общего числа заболеваний, а в таких странах как США смертность от онкологических заболеваний выходит на лидирующее место. Согласно мировой статистике опухолевые заболевания ежегодно диагностируются более чем у 12 млн. человек. В структуре смертности населения Российской Федерации злокачественные новообразования занимают третье место (13,3%) после болезней сердечно-сосудистой системы (55,3%) и травм и отравлений (14,3%). Так, в территориальных специализированных онкологических учреждениях Российской Федерации состоят на учете порядка 2-х миллионов человек с установленным диагнозом злокачественного новообразования. Абсолютное число умерших от злокачественных новообразований жителей Российской Федерации при этом составляет ежегодно порядка 300 тыс. человек.
Химиотерапия является важнейшим звеном в системе лечения онкологических больных и применяется в 65% случаев лечения злокачественных новообразований. Ее назначают не только как элемент комплексного и комбинированного лечения, дополняя традиционные хирургические и лучевые методы, но и самостоятельно при некоторых видах и локализациях опухолей. При этом наблюдается не только субъективное и объективное улучшение, продление ремиссии и продолжительности жизни больных, но и даже полное выздоровление в ситуациях, ранее считавшихся безнадежными.
В настоящее время препараты на основе драгметаллов платиновой группы, а именно платины, занимают одно из ведущих мест в лечении злокачественных новообразований. За 35 лет работы над созданием препаратов на основе платины в онкологическую практику внедрены три препарата - цисплатин, карбоплатин и оксалиплатин, применяемые при лечении 23 форм рака (из 33 видов) в основном в виде полихимиотерапии, 170 схем которой (из 400) разработаны с участием этих препаратов.
Цены на препараты на основе платины достаточно высоки и определяются фирмой-производителем. Оптовая цена препаратов колеблется в широком диапазоне цен: цисплатин -5-10 тыс. руб. за 1 г, карбоплатин - 13-20 тыс. руб. за 1г, оксалиплатин -250 тыс. руб. за 1 г, при этом стоимость платины в них возрастает от 15 до 700 раз по сравнению со стоимостью аффинированного металла. При этом экспертная оценка рыночной стоимости 1 г морфозола в лекарственной форме, исходя из минимальной стоимости цисплатина и карбоплатина на стадии внедрения, может составить порядка 4000 руб./г.
Однако спектр действия известных противораковых препаратов, в том числе и платиносодержащих, ограничен новообразованиями нескольких локализаций, а иногда только одной опухолью или её морфологическим вариантом. Многие широко распространенные новообразования (например, рак желудка) не чувствительны к ним. При повторных курсах химиотерапии развивается резистентность (устойчивость) опухоли к препарату.
Существующие противоопухолевые препараты имеют недостаточную избирательность, что приводит к развитию токсических реакций со стороны организма, не позволяющих проводить лечение в полном объеме вследствие угнетения иммунной системы, кроветворной функции костного мозга, нарушения жизнедеятельности сердечно-сосудистой и нервной систем, печени, почек и др.
Высокая токсичность соединений платины, наличие побочных реакций и осложнений, резистентность опухолей к ним делает необходимым поиск новых препаратов с иным механизмом действия, способных повысить эффективность медикаментозного лечения опухолевых заболеваний, что признано мировым сообществом одной из фундаментальных проблем биомедицинской химии, экспериментальной и клинической онкологии.
Анализ зарубежных публикаций, посвященных синтезу новых соединений в ряду платиновых металлов свидетельствует о перспективности поиска новых противоопухолевых средств именно среди соединений палладия. Так за период 1996-2003 гг. синтез новых соединений палладия описан в 453 публикациях и 24 из них были подвергнуты тестированию биологической активностью. Поиск новых комплексов палладия с высокой противоопухолевой активностью осуществляется прежде всего потому, что соединения палладия значительно менее токсичны по сравнению с соединениями платины. Об этом свидетельствуют данные о токсичности палладия и его соединений, приведенные в докладе Всемирной организации здравоохранения за 2002 год по разделу «Палладий».
В конце 2002 г. в Mining Weekly появилось сообщение о новом возможном применении палладия, как основы «нового мощного оружия для борьбы против рака». Бразильские ученые из Университета штата Сан-Паоло - University of Mogi Crures -синтезировали металлоорганическое соединение палладия, которое in vivo (на крысах) продемонстрировало высокую противоопухолевую и антиметастатическую активность. Работы субсидировались (~ 2 млн. $) Фондом развития научных исследований штата Сан-Паоло.
Анализируя патентно-лицензионную ситуацию с препаратами ряда платины следует отметить, что базовые патенты на вещество, разрешенных к применению препаратов, уже прекратили сроки своего действия за давностью лет. Важнейшим признаком фармацевтических препаратов, разрешенных к применению, является наличие охранных документов на их лекарственную форму.
При поиске на глубину в 15 лет на дату получения патента, что соответствует глубине поиска до 20 лет по приоритету, выявлено всего четыре препарата с запатентованными лекарственными формулами. Цисплатин: Rhone-Poulenc Rorer (Франция) - 1993г., Sumitomo Pharmaceutical Co. (Япония) - 2000г. Карбоплатин: Pharmachemie (Нидерланды) – 1990, Max-Delbruck centrum (Германия) - 1992г., Rhone-poulenc Rorer (Франция) - 1993г., Kiss Laboratories S.R.O. (Чехия) - 1994г. Оксалиплатин: Debiopharm (Швейцария) - 1994г.; Sanofi (Великобритания) -1998, 1999г. Циклоплатам: Онкоцентр РАМН - 1998г.
Разработкой соединений палладия, обладающих противоопухолевой активностью в последние годы занимаются многие научные коллективы разных стран.
С точки зрения чистоты правового поля наиболее перспективным направлением является цикл работ по синтезу биологически активных комплексов палладия, обладающих противоопухолевой активностью. Упомянутая международная патентная заявка PCT/RU 02/00495 на новый класс комплексов палладия с гетероциклическими лигандами имеет признаки базисного или пионерского изобретения и сравнима по объему охраны с цисплатином, давшим научное направление синтезу платиновых противоопухолевых препаратов, что указывает на перспективность развития работ по созданию новых противоопухолевых препаратов на основе соединений палладия. Анализ патентной информации показывает, что преимущественно патентование осуществляется на этапе поиска и экспериментальных исследований различных соединений палладия, кроме того соединений, близких по структуре Морфозолу в данных разработках не выявлено. В целом же, по мнению специалистов, композиции, включающие данное соединение, облают мировой новизной.
Цель разработки противоопухолевых препаратов на основе палладия
Создание новых противоопухолевых препаратов, способных повысить эффективность медикаментозного лечения опухолевых заболеваний, открытие каждого нового класса противоопухолевых препаратов приводит к достижению принципиально новых возможностей в лекарственном лечении опухолевых заболеваний. Выявление нового класса противоопухолевых препаратов позволяет рассчитывать на расширение областей эффективного применения химиотерапии за счет увеличения номенклатуры чувствительных опухолей, снижения токсичности лечения, уменьшения вероятности развития перекрестной и множественной лекарственной устойчивости опухолей.
Характеристика нового класса палладий содержащих соединений
Изучение комплексов палладия (II) с целью поиска новых соединений, обладающих противоопухолевой активностью, началось практически сразу же, параллельно исследованию цисплатина. Анализ зарубежных публикаций, посвященных синтезу соединений палладия с целью поиска новых противоопухолевых средств показывает, что только за период 1996-2003 гг. синтез новых соединений палладия описан в 453 публикациях, в 24 из них была тестирована биологическая активность.
Новый класс палладийсодержащих соединений, обладающих противоопухолевой активностью (AHn)m[PdCl4], был создан российскими химиками НИИ неорганической химии РАН (под руководством профессора Ефименко Инэссы Александровны). Исследователями был найден оригинальный подход к созданию стабильных палладийсодержащих структур, способных обеспечить доставку активного действующего начала - палладия - к клеточным мишеням, приостанавливая тем самым рост злокачественной опухоли и ее метастазирование.
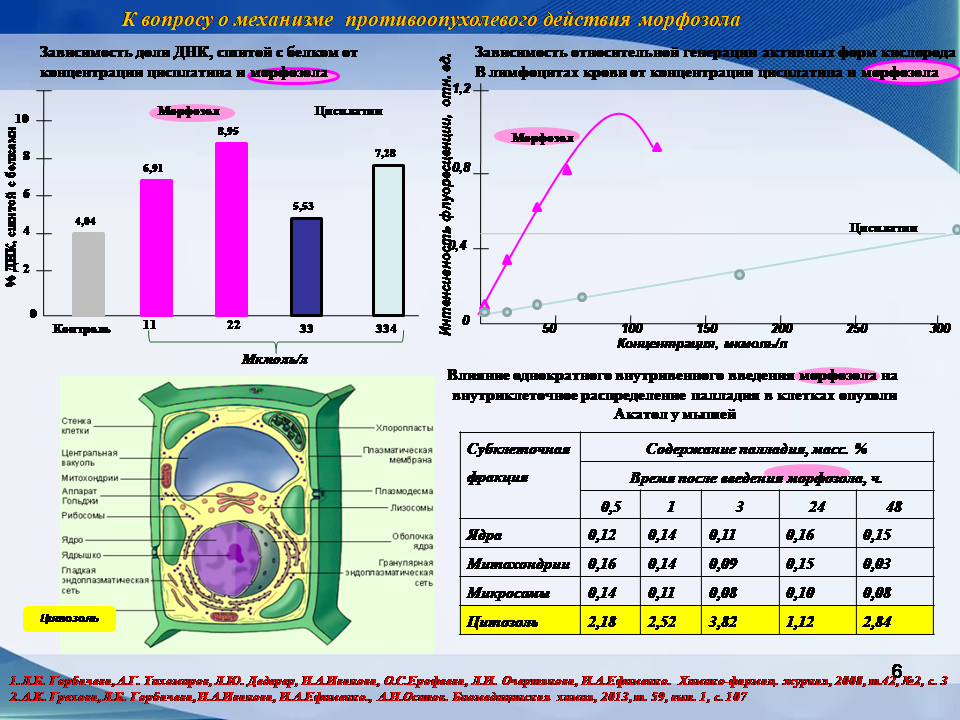
Данные, полученные при изучении взаимодействия K2PdCl4 и (AHn)m[PdCl4], где А – азотсодержащий лиганд, с ДНК in vitro, свидетельствуют о том, что при действии комплексов палладия, содержащих [PdCl4]2- - ион на ДНК не происходит фрагментации ДНК, но образуются как внутринитевые, так и межнитевые сшивки, при этом преимущественно образуются PdAG аддукты в отличие от аддуктов, образуемых с ДНК цисплатином. Взаимодействие комплексов палладия с ДНК сопровождается и изменением физико-химических характеристик исходной ДНК – вязкости, величины двойного лучепреломления, АСМ – изображения и др.
Авторы отмечают наличие принципиальных различий в механизме действия палладийсодержащих комплексов по сравнению с платиносодержащими противоопухолевыми препаратами. Ключевой механизм противоопухолевого, антиметастатического и/или радиопротекторного действия палладийсодержащих препаратов связан с ингибирующим действием комплексов палладия на внутриклеточные ферментные группы, в частности, катепсин В. В значительно меньшей степени активность палладийсодержащих препаратов связана с образованием катионно-анионных комплексов с пуриновыми и пиримидиновыми основаниями внутриклеточных ДНК. При этом отмечается, то данный механизм существенно отличается от платиносодержащих препаратов в части образования аддуктов.
Механизм противоопухолевого действия палладийсодержащих препаратов определяется, в отличие от цисплатина, накоплением палладия в цитозоле клетки, содержание которого превышает его содержание в ядре в 20 раз, что сопровождается активным ингибированием ферментов цитозоля типа серин-пептидазы, цистеин-протеазы, эндо-пептидазы и др. Генерируя активные формы кислорода, морфозол вызывает апоптоз злокачественных клеток, а также подобно действию цис-платина образует сшивки ДНК-ДНК и ДНК – белок. Для палладийсодержащих препаратов характерна реверсивность (обратимость) его действия на здоровые клетки, обеспечивая тем самым его низкую цитотоксичность и снижение побочных эффектов.
Комплекс, послуживший основой для разработки нового противоопухолевого препарата Морфозол, синтезирован в ИОНХ РАН. В настоящее время все работы по препарату Морфозол, как и по ряду других, синтезированных под руководством профессора Ефименко И.А. палладийсодержащих соединений, ведет ООО «Радифенс». В частности, ООО «Радифенс» занимается совершенствованием синтеза и лекарственной формы препарата Морфозол, дальнейшим изучением способов применения препарата. Подготовлены заявки на патентование лекарственной формы, способа синтеза и применения препарата Морфозол и регистрацию товарного знака.
Морфозол - представитель нового класса противоопухолевых препаратов из группы платиновых металлов (платина, палладий, родий, иридий, рутений, осмий). Представляет собой координационное соединение палладия – ацидокомплекс палладия - (C5H12NO)2[PdCl4].
Палладийсодержащий противоопухолвый препарат Морфозол является представителем препаратов из группы платиновых металлов. Химия платины Pt(ll) и палладия Pd(ll) имеет много сходных черт, поэтому наиболее близкими Морфозолу по химической структуре и свойствам являются платиносодержащие противоопухолевые препараты.
Препарат Морфозол является одним из наиболее активных соединений, обладающих выраженными противоопухолевыми и антиметастатическими свойствами среди палладийсодержащих структур, синтезированных под руководством профессора Ефименко И.А.
Это первая отечественная разработка, имеющая исключительные лечебные свойства, благодаря соединениям палладия, впервые используемым в онкологии и вообще в медицинской практике. Сегодня имеются все основания, чтобы довести Морфозол до необходимой степени фармацевтической готовности, организовать его высокорентабельное производство и дать онкологам средство, эффективное в борьбе с раковыми заболеваниями.
Экспериментальное изучение противоопухолевой активности Морфозола показало, что он обладает широким спектром действия и значительно превосходит близкие по химической структуре платиносодержащие противоопухолевые препараты по показателю выживаемости животных с привитыми злокачественными опухолями (основному показателю эффективности лечения в соответствии с рекомендациями ВОЗ).
Предварительные исследования показали, что наиболее целесообразной лекарственной формой препарата Морфозол является:
- порошок для приготовления раствора для внутривенного введения;
- раствор для внутривенного введения
- раствор для инфузий
Технологический процесс получения субстанции Морфозола достаточно прост в аппаратном оформлении. Основные операции по растворению палладия и синтезу продукта могут быть проведены в одном реакторе с перемешивающем устройством, с системой дозировки реагентов и обогрева реакционной среды. Хорошая фильтруемость осадков позволяет использовать стандартные нутч-фильтры. Разработанная методика синтеза субстанции Морфозола может лечь в основу технологии его производства.
Предварительные исследования препарата Морфозол позволили сделать заключения о том, что:
- Морфозол обладает широким спектром действия (7 штаммов опухолей) и значительно превосходит платиносодержащие препараты по показателю выживаемости основному показателю эффективности лечения в соответствии с рекомендациями ВОЗ;
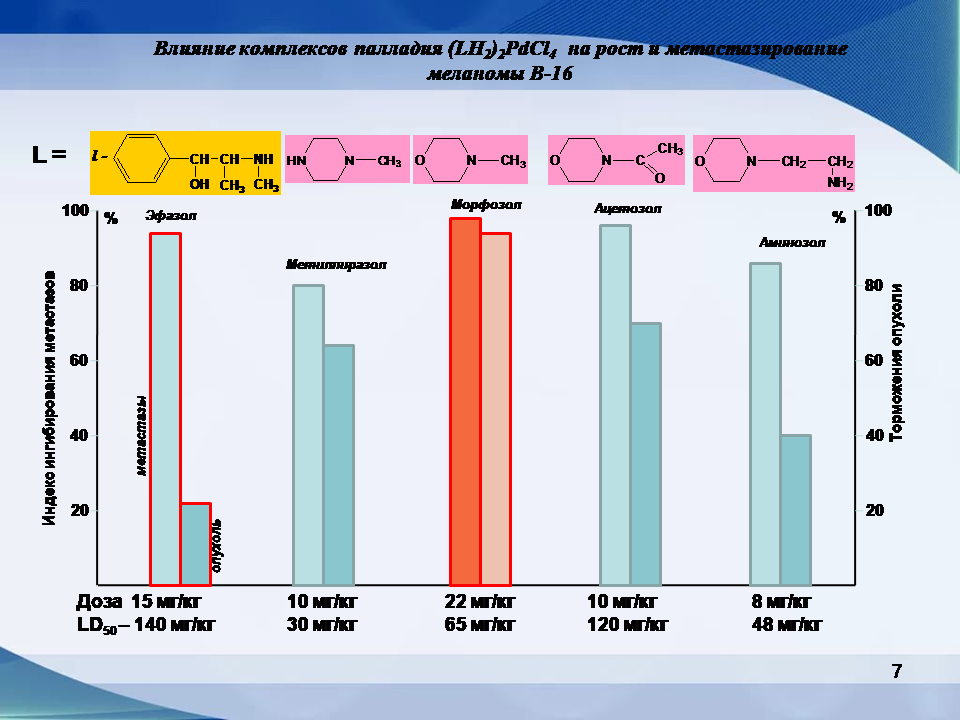
- Морфозол характеризуется высокой антиметастатической активностью (индекс ингибирования метастазов 95-99%);
- Принципиальным отличием Морфозола от платиносодержащих цитостатиков является отсутствие иммуносупрессорного (подавляющего иммунитет) действия на организм. В противном случае, как в случае препаратов платины, наблюдается угнетение кроветворной функции костного мозга, нарушение жизнедеятельности организма, что не позволяет проводить лечение в полном объеме (прекращение лечения) и требует длительной нормализации основных функций организма для продолжения жизни;
- Морфозол в отличие от соединений платины не обладает аллергизирующим и анафилактоидным действием, эмбриотоксическими свойствами, мутагенным эффектом, что делает возможным лечение и молодых женщин и даже беременных, не опасаясь за здоровье будущего поколения;
- Предклинические токсикологические и патоморфологические исследования свидетельствуют, что токсичность Морфозола в 5 раз ниже, чем, например, у цисплатина.
- Изменения структуры внутренних органов, возникающие под воздействием Морфозола, носят обратимый характер. Палладий быстро выводится из организма (через 10-12 часов), в отличие от соединений платины, остающихся в организме до 30 суток; имеющиеся данные свидетельствуют об ином механизме действия палладийсодержащих соединений по сравнению с платиносодержащими цитостатиками;
- Технологическая схема получения субстанции Морфозола очень проста и практически одностадийна, в то время, как получение всех препаратов платины - сложный многостадийный процесс;
- Морфозол - стабильное соединение, которое даже в терапевтическом растворе остается неизменным более одного года, в то время как, например, цисплатин в растворах довольно быстро теряет свою активность за счет превращения в неактивное транс-соединение;
- Стоимость Морфозола будет значительно ниже по сравнению с платиносодержащими препаратами;
Потенциальные клинические показания:
- по всем показаниям платиновых цитостатиков после удаления первичной опухоли с целью препятствия развития процесса метастазирования
- профилактики и раннего лечения острой лучевой болезни (ОЛБ)
- в качестве более безопасного противоопухолевого препарата по аналогичным платиновым препаратам показаниям
- в качестве противоопухолевого препарата при наличие резистентности к платиновым препаратам
- в комбинации с лучевой терапией для достижения более высокого уровня противоопухолевой активности
- благодаря наличию дополнительного радиопротекторного действия, препарат также должен иметь предпочтение перед платиновыми цитостатиками в комбинированных схемах терапии – химиолучевой.
Эфазол имеет близкий к препаратам платины механизм действия. Исследование взаимодействия катионно-анионных комплексов палладия с ДНК показало их активное связывание с пуриновыми и пиримидиновыми основаниями ДНК.
Эфазол значительно более безопасный по сравнению с близкими клиническими аналогами – платиновыми цитостатиками. Поэтому в отличие от платиновых цитостатиков может использоваться более широко и в большем числе случаев доводить лечение до конца.
Препарат не оказывает побочного действия в широком диапазоне лечебных доз.
Противолучевой эффект достигается при дозах 10-15 мг/кг, и дальнейшее их повышение не приводит к заметному изменению уровня выживаемости облученных животных. Следовательно, оптимальная доза более, чем в 10 раз ниже СД50, что может служить определенной гарантией безопасности использования данного соединения.
Чрезвычайно важным свойством Эфазола, выгодно отличающим его от большинства используемых в онкологии цитостатиков, и, особенно, платиносодержащих, является отсутствие у него иммуносупрессорного действия на организм, что значительно облегчает состояние организма, подвергающегося действию противоопухолевого препарата.
Наличие структурных отличий у палладийсодержащего препарата Эфазол в отличие от платиновых препаратов (наряду с существующим сходством) обеспечивает ему свойства, которые позволят использовать при опухолях, резистентным к платиновым цитостатикам,
Внедрение Эфазола поможет решить проблему приобретенной резистентности (нечувствительности) больных к химиотерапии препаратами на основе платины, что, безусловно, улучшит прогноз излечиваемости заболеваний и увеличит продолжительность жизни больных.
Эфазол претендует также на использование для лечения опухолей, не поддающихся лечению другими существующими цитостатиками и не медикаментозными методами.
Принципиальное отличие в строении комплексов палладия по сравнению с известными комплексами платины, обладающими противоопухолевой активностью, позволяет также прогнозировать выявление оригинальных качественных отличий и разработку новых схем лечения онкологических больных.
Важной следует рассматривать информацию об отсутствии перекрестной резистентности у соединений палладия и платины.
Эфазол имеет сравнимую противоопухолевую активность с платиновыми противоопухолевыми препаратами, но в отличие от последних, имеет выгодное преимущество – способность препятствовать образованию и развитию метастаз. При этом Этазол не только замедляет или прекращает рост первичной опухоли и сформировавшихся метастазов, но и предотвращает их образование.
В качестве модели для проведения экспериментальных исследований были выбраны хорошо метастазирующие опухоли меланомы В-16 и карциномы легких Льюиса. Антиметастатическая активность эфазола наблюдается значительная, независимо от пути (внутривенный или внутрибрюшинный) его введения. Как следует из приведенных данных, эфазол умеренно ингибирует развитие метастатического процесса при карциноме легких Льюиса.
Выявлена способность Эфазола усиливать противоопухолевый эффект лучевой терапии на моделях опухолей АК-755 или карциномы Эрлиха (штамм ELD) при однократном или фаркционированном облучении. Комбинированное применение эфазола с облучением приводит к значительной регрессии опухолей в то время как один эфазол или одно облучение такого эффекта не дает.
Препарат обладает профилактическим и лечебным радиопротекторным действием, в отличие от близких клинических аналогов, что позволяет рекомендовать его для включения в различные схемы лучевой и химиолучевой терапии.
Эфазол, благодаря наличию дополнительного радиопротекторного действия будет иметь предпочтение перед платиновыми цитостатиками в комбинированных схемах терапии – химиолучевой.
Открытие нового вида биологической активности - радиомодифииируюшей активности, присущей определенному типу соединений палладия, в противоположность соединениям платины, было первым интересным для практики результатом системного изучения биокоординационной химии палладия и платины. Оно базировалось на результатах специфического воздействия соединений палладия на мембраны клеток (стабилизации), поскольку современной радиобиологией признано большое значение поражения клеточных мембран и встроенных в них структур при радиационном облучении организма [Патент RU № 2022968 Соединения на основе палладия и производных ароматических аминов и способ их получения, приоритет от 12.05.92 г., Бюл. № 21, 15.11.94 г.].
Эфазол в онкологии и радиационной медицине может применяться для коррекции лучевого и цитостатического иммунодефицита: он позволяет купировать состояние вторичного иммунодефицита, стимулируя как гуморальное, так и клеточное звено иммунитета.
Показана возможность создания на основе палладия иммуномодулятора (эфазол), способного корректировать иммунный ответ организма при иммунодефицитных состояниях, вызванных облучением или противоопухолевыми препаратами, тем самым существенно увеличивать терапевтический эффект канцеростатиков и облучения вкомбинированной терапии опухолей.
Гемостимулирующие свойства Эфазола проявляются после повторных введений препарата в виде ускорение восстановления основных показателей гемопоэза после радиационного воздействия. При этом эфазол оказывает нивелирующее действие на цитогенетическую стабильность эритроцитов и лейкоцитарную формулу крови, подвергшихся изменению при воздействии облучения.
Исследования же влияние эфазола на кроветворные клетки-предшественники - на процессы, происходящие в S фазе цикла кроветворных клеток, показали, что Эфазол не оказывает существенного влияния на процессы, происходящие в S фазе клеточного цикла.
Результаты экспериментальных исследований указывают на довольно значительную антиметастатическую активность Комплекса при опухоли толстого кишечника. Опухоль АКАТОЛ прививали путем введения 106 опухолевых клеток в селезенку мышей. Предварительно животные получали гексеналовый наркоз, (в концентрации 15 мг/кг; 0,16 мл на мышь) после чего через разрез в брюшной стенке выводили селезенку и в ее полюс инъецировали опухолевые клетки. Оценку эффекта проводили на 20-е сутки после перевивки.

